2 Diagnostik und Therapie von Muskelerkrankungen
2.1 Diagnostische Verfahren
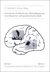
Das diagnostische Vorgehen bei Myopathien ergibt sich aus der klinischen Zuordnung gemäß Anamnese und klinischer Untersuchung. Eine Übersicht über die verschiedenen diagnostischen Verfahren bietet Abbildung 2.1: Bei vielen Myopathien geben Zusatzsymptome, Familienanamnese und die Verteilung der Paresen eine typische „Gestalt“. Die nicht-spezifischen Zusatzuntersuchungen (gestrichelt umrahmt) helfen, den aktuellen Zustand des Patienten zu charakterisieren. Sie präzisieren die klinische Verdachtsdiagnose und bestimmen das weitere diagnostische Vorgehen zur Diagnosesicherung (grau hinterlegt). Bei einem Teil hereditärer Myopathien führt die molekulargenetische Mutationssuche direkt zur Diagnosebestätigung. Bei einer entsprechenden Verdachtsdiagnose kann auf eine Muskelbiopsie verzichtet werden. Die Aussagekraft der Muskelbiopsie wird verbessert durch die Anwendung optionaler Zusatzmethoden wie Western Blot-Analyse, Immunhistochemie u. a. Auch hierfür ist eine möglichst exakte klinische Zuordnung Voraussetzung. Wenn mehrere Familienmitglieder betroffen sind, ist die Kopplungsanalyse eine diagnostische Option zur Bestimmung des Genlokus und damit eines Kandidatengens zur Mutationsanalyse. Das Für und Wider der Untersuchungsverfahren ist in Tabelle 2.1 aufgelistet.
Abb.2.1: Myopathieabklärung – das diagnostische Vorgehen ist abhängig vom klinischen Befund
Tab.2.1: Muskelerkrankungen – Diagnostik
Anamnese und Befund | Bilden die Grundlage diagnostischer Überlegungen Ermöglichen eine syndromale Zuordnung |
Elektromyographie | Ermöglicht die Einteilung in: |
| Myogen/neurogen Akut/chronisch |
Aber: Erlaubt meist keine spezifische Diagnose Hat ein Sampling Problem Ist abhängig von der Kooperation des Patienten |
Magnetresonanztomographie des Muskels | Erlaubt eine anatomisch präzise Abbildung verschiedener Muskelgruppen Gibt einen Überblick der Läsionsverteilung Zeigt zwei unterschiedliche Signalveränderungen: |
| Vermehrte Fetteinlagerung (T1w, T2w) Vermehrte Wassereinlagerung (STIR, fettgesättigt, T2w) |
Aber: Erlaubt meist keine spezifische Diagnose |
Muskelbiopsie | Sichert häufig die Diagnose Ergänzende Methoden: |
| Immunhistochemie Western Blot Analyse mitochondrialer DNA |
Aber: Sampling Problem (kleiner Ausschnitt von Muskelgewebe) Invasiv mit Narbe, Auswertung zeitaufwändig Nicht diagnostisch bei Endstadienmuskel Irreführend z. B. bei fazioskapulohumeraler Muskeldystrophie, Becker-Dystrophie |
Molekulargenetik | Erlaubt bei hereditären Erkrankungen eine Zuordnung zu spezifischen Gendefekten Aber: Die klinische Diagnose muss korrekt sein Einfach nur bei bestimmten Mutationstypen |
| Deletion, Insertion Repeat-Expansion Punktmutationen, wenn sie eine hohe Prävalenz haben (z.B. LGMD2I) |
In vielen Fällen kann mit Hilfe einer gründlichen Anamnese und des klinischen Befundes bereits eine Verdachtsdiagnose gestellt werden, die die Zahl der in Frage kommenden Erkrankungen deutlich eingrenzt (Tab. 2.2). In den meisten Fällen werden Zusatzuntersuchungen notwendig, die jedoch oft nur bei guter klinischer Einordnung zur korrekten Diagnose führen. Muskelenzyme, Elektromyographie und zunehmend auch bildgebende Verfahren (v. a. MRT) sind sinnvolle Ergänzungen des klinischen Untersuchungsbefundes, erlauben aber meist noch keine definitive Diagnose. Trotz der Fortschritte der immunhistochemischen Färbemethoden führt auch die Muskelbiopsie keineswegs immer zur korrekten Diagnose – sie ist in vielen Fällen nicht mehr der diagnostische „Goldstandard“, da sie keineswegs immer spezifisch deutbare Befunde liefert und da die Diagnose in einer zunehmenden Zahl von Fällen durch die Anwendung molekulargenetischer Methoden allein gesichert werden kann. Die Treffsicherheit molekulargenetischer Methoden ist wiederum abhängig von der korrekten klinischen Diagnose, so dass letzten Endes nur die Kombination des klinischen Befundes und der unterschiedlichen Zusatzuntersuchungen die Diagnose sichert.
Tab.2.2: Neuromuskuläre Erkrankungen mit charakteristischer klinischer Manifestation (Verdachtsdiagnose bereits nach der klinischen Untersuchung möglich)
Dystrophien (s. Kapitel 3) | Duchenne-Dystrophie Fazioskapulohumerale Muskeldystrophie Emery-Dreifuss-Dystrophie Oropharyngeale Muskeldystrophie |
Metabolische Myopathien (s. Kapitel 5) | Mitochondriale Myopathie mit CPEO M. Pompe (saure Maltase-Mangel) bei Zwerchfellbeteiligung |
Myotonien (s. Kapitel 6) | Myotone Dystrophie I Curschmann-Steinert Myotonia congenita Becker/Thomsen |
Myositiden (s. Kapitel 7) | Dermatomyositis Einschlusskörpermyositis |
Endokrine Myopathien (s. Kapitel 8) | M. Cushing Hypothyreose |
Endplattenerkrankung (s. Kapitel 9) | Myasthenia gravis |
Vorderhornzellerkrankungen (s. Kapitel 10) | Vollbild der amyotrophen Lateralsklerose Bulbospinale Muskelatrophie |
2.1.1 Anamnese und klinische Untersuchung
Wie in anderen Bereichen der Medizin, ergeben sich auch bei den Muskelerkrankungen aus der qualifiziert erhobenen Anamnese mit Erfassung des Beschwerdebildes und detaillierten klinischen Untersuchungen zumeist die entscheidenden Informationen, die zur diagnostischen Zuordnung des Krankheitsbildes führen. In der Anamneseerhebung gilt es bei Muskelerkrankungen insbesondere
- Erblichkeit,
- Manifestationsalter,
- Verlaufsdynamik und die
- Besonderheiten eventuell vorhandener Paresen
herauszuarbeiten. Wegen des großen Anteils hereditärer Myopathien ist die Erhebung der Familienanamnese unverzichtbarer Bestandteil der klinischen Untersuchung.
Da Muskelschwäche alleine nicht pathognomisch für Muskelerkrankungen ist, kommt dem klinischen Verlaufs- und Verteilungsmuster der Paresen eine besondere Bedeutung bei der Differenzialdiagnose zu. Im Rahmen der klinischneurologischen Untersuchung muss deshalb eine detaillierte Überprüfung der Kraftentwicklung der einzelnen Muskelgruppen erfolgen, um das Verteilungsmuster der Muskelschwäche wie ein Gliedergürtelsyndrom zu erfassen. Die Kraftentwicklung des Muskelgesunden wird normalerweise als nicht überwindbar beschrieben, ist aber natürlich abhängig vom Lebensalter, Trainingszustand und Ausgangsposition bei der Prüfung. Für alle Untersucher ist es deshalb sinnvoll, den Muskelstatus auch an einem Querschnitt muskelgesunder junger und alter Menschen zu erheben, um die normale Kraftentwicklung einzelner Muskelgruppen einschätzen zu können. In Halteversuchen kann eine myasthene Schwäche erfasst werden.
Beachte: Muskelschwäche ist auch ein häufiges Symptom von Patienten mit somatoformen Störungen. Bei der Prüfung der betreffenden Muskelgruppen zeichnet sich die somatoforme Parese oft dadurch aus, dass zunächst eine gute Kraftentwicklung zu beobachten ist, die dann ruckartig nachlässt. Bei mehreren Prüfungen zeigen sich variable Ergebnisse. Weiterhin ergeben sich bei einem somatoformen Geschehen häufig Diskrepanzen zwischen der Kraftentwicklung in Alltagssituationen, wie dem Aus- und...